L’histoire de la chaîne du froid des vaccins
La découverte d’un vaccin n’est que la toute première étape : affirmation toujours valable depuis l’époque du docteur Edward Jenner. Le déployer à l’échelle mondiale exige de résoudre un grand nombre de problèmes.
- 14 mai 2024
- 16 min de lecture
- par Personnel de Gavi

Un matin, récemment – imaginons que nous parlions de ce matin – dans des villages à la terre ocre, verdoyants ou au sable couleur cannelle ; dans des villes grouillantes et bruyantes recouvertes d’asphalte et d’installations en béton en porte-à-faux ; dans des zones broussailleuses urbaines laissées à l’abandon, où les tours s’inclinent à mesure qu’elles s’élèvent ; dans des cliniques qui se composent d’une seule et unique pièce, des sandales en plastique attendant docilement sous le porche ; ou dans des structures soignées derrière des rangées bien taillées de buissons fleuris ; sous l’ombre vaste d’un arbre immense, ou dans l’ombre noire d’un nuage, ou sous le souffle de la fournaise du soleil du désert, la porte d’un réfrigérateur s’est ouverte.
À l’intérieur, une ampoule s’est allumée, projetant une lumière sur le visage d’un membre du personnel de santé. Il s’agit de la coureuse de « l’avant-dernier kilomètre » d’une très longue course de relais qui se déroule sans interruption depuis le milieu des années 1970.
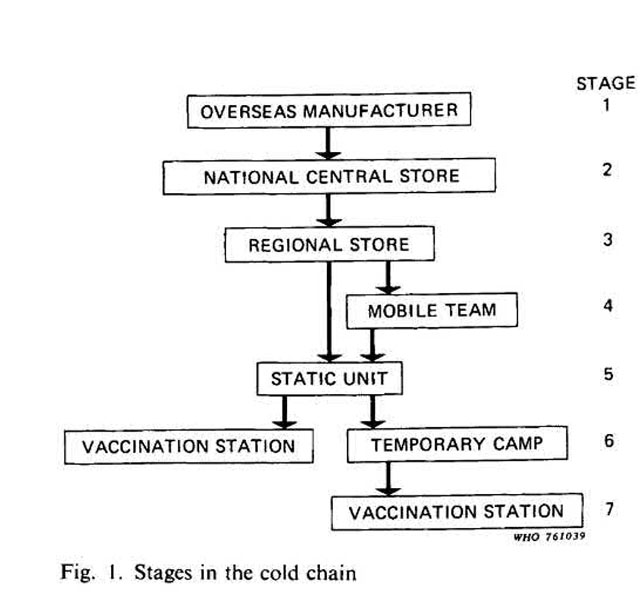
Le trajet de la course commence de manière radiale, à l’image des rayons sur la roue d’une charrette, puis se ramifie. Les moyeux des roues représentent les sites de production. Des avions décollent vers tous les pays. Dans chaque pays, un réseau capillaire fin, fragile, mais remarquablement résistant, mène à presque tous les lieux où vivent les populations.
Il s’agit de la représentation de la chaîne du froid des vaccins. Quand on y pense, c’est assez incroyable.
Un projet gigantesque à l’échelle mondiale
Depuis 1974, le monde a sauvé 154 millions de vies grâce à la vaccination. Cela a nécessité des centaines de milliers de paires de mains et des centaines de milliers de réfrigérateurs, de congélateurs et de dispositifs passifs.
Les chiffres absolus ne sont pas connus. Mais nous pouvons vous dire que depuis 2017 seulement, Gavi, par le biais de sa plateforme d’optimisation des équipements de la chaîne du froid (CCEOP) et de COVAX, a contribué à l’approvisionnement de :
- Plus de 37 000 réfrigérateurs et congélateurs à gaine réfrigérante (ILR) ;
- Plus de 45 000 réfrigérateurs et congélateurs à entraînement solaire direct (SDD) ;
- Plus de 200 chambres froides ou entrepôts frigorifiques ; et
- Plus de 23 000 glacières
...pour permettre de consolider la chaîne du froid des vaccins dans plus de 50 pays.
Le membre du personnel de santé qui se trouve à la porte du réfrigérateur regarde les flacons. Son travail consiste à vérifier, compter, stocker, empiler, mesurer, enregistrer, conserver. Elle a entre les mains un crayon, du papier et des outils de contrôle automatisés. Il est nécessaire d’être méthodique : ce travail est à la fois routinier et une question de vie ou de mort.
Les vaccins sont puissants, mais ils demandent de la patience. Tous les flacons conservés dans ce réfrigérateur doivent rester à des températures comprises entre deux et huit degrés Celsius. Ils ont parcouru tous ces kilomètres sans jamais descendre en dessous ou monter au-dessus de cette plage de températures. Toutefois, il est encore possible de faire un faux pas avant la ligne d’arrivée. Dans ce cas, ils perdront leur efficacité et devront être éliminés.
L’étape suivante est le transfert. Les coureurs du « dernier kilomètre » attendent avec des porte-vaccins bleus en bandoulière. Les membres de notre personnel de santé renseigneront leur inventaire de la journée, puis ils partiront d’ici – en parcourant de courtes ou de longues distances, à pied, à vélo, en voiture, en bateau, sur des ânes, des poneys, des chameaux, des canoës ou des radeaux à l’apparence douteuse, en passant par des postes de contrôle, en franchissant des ponts étroits, en montant sur des échelles, et ainsi de suite – jusqu’à un endroit où les enfants ont besoin de vaccins.
La ligne d’arrivée et la récompense de la course de relais sont les mêmes : un enfant vacciné. Et la course se répète inlassablement. Chaque année, environ 134 millions d’enfants naissent vulnérables.
Le problème d’un vaccin stable
Le vaccin antivariolique existait depuis plus d’un siècle et demi lorsque, lors de la 11e Assemblée mondiale de la santé (AMS) en 1958, la délégation de l’URSS a appelé à l’éradication du virus à l’échelle mondiale.
La variole n’était plus présente dans les pays qui avaient réussi à vacciner régulièrement leurs populations : en d’autres termes, le vaccin lui-même fonctionnait bien. Mais de vastes étendues de la carte du monde restaient exclues d’un accès fiable. Dans ces endroits, les populations demeuraient en danger – environ 50 millions de cas de variole apparaissaient chaque année dans le monde – et le virus trouvait un refuge là où il pouvait lancer de nouvelles attaques.
Depuis la découverte du vaccin à la fin du 18e siècle, une difficulté persistait : transporter la matière virale immunisante – une substance vivante – sans qu’elle ne perde de son efficacité.
Pendant longtemps, la solution la plus fiable1 a consisté à le transporter dans le corps d’une personne, un processus appelé vaccination de « bras à bras ». En voici une description toute simple : un enfant a été vacciné avec le virus de la « variole de la vache » (ou encore vaccine ou cowpox en anglais), un virus bénin qui protège naturellement contre sa cousine mortelle, la variole ; sa réponse immunitaire a provoqué la formation d’une pustule sur son bras, à l’endroit de l’injection du vaccin ; avant qu’elle ne guérisse, la substance à l’intérieur de la pustule a été prélevée et injectée à un autre enfant.
De très nombreux enfants ont été protégés de cette manière. Mais cette méthode de distribution présentait de gros inconvénients sur le plan logistique. Si l'on vaccinait trop d’enfants à la fois ou qu'on ne trouvait que peu de candidats, on risquait de briser la chaîne – c’est-à-dire de ne pas avoir à portée de main une pustule non guérie quand on en avait besoin pour un enfant non vacciné.
Si le vaccin devait voyager, un enfant devait également voyager – et si le trajet consistait en un long voyage en mer, il fallait éventuellement prévoir d’avoir un certain nombre d’enfants à bord. Et même dans ce cas, il existait toujours le risque que le vaccin ne « prenne pas » – pas de pustule, plus de vaccin. La vaccination quasi universelle par ce moyen aurait été une véritable gageure.
Au milieu du 19e siècle, les animaux avaient été intégrés dans la chaîne d’approvisionnement des vaccins. Le principe était le suivant : la variole de la vache était insérée dans une longue incision pratiquée dans le flanc d’un veau, d’un mouton ou d’un buffle et, quatre jours plus tard, la lymphe était prélevée pour être utilisée. En d’autres termes, la lymphe vaccinale pouvait désormais être « cultivée ».

Dans les années 1900, il était courant d’ajouter de la glycérine pour prévenir la transmission d’infections bactériennes en même temps que le virus du vaccin. Les scientifiques ont démontré que ce processus permettait également de mieux conserver les stocks de vaccins, bien que des températures plus élevées compromettaient leur longévité.
Pour aller plus loin
Au fur et à mesure, le vaccin est devenu un produit plus régulier et plus fiable, mais il n’était pas encore assez stable pour résister aux longs trajets. À l’aube du 20e siècle, des tubes de lymphe de veau glycérinée, expédiés depuis l’Angleterre, arrivent dans les colonies d’Afrique et d’Asie « inutilisables » – terme utilisé par un gouverneur en Gambie et un chirurgien en Ouganda. D’autres méthodes de conditionnement et de conservation, des pointes en ivoire déjà munies de lymphe de veau par exemple, ont été testées sans grand succès. La création de fermes de vaccination, en Afrique de l’Est par exemple, a été envisagée comme solution, mais pour des raisons coloniales2 et complexes, cette idée ne s’est jamais concrétisée.
Une proposition de refroidissement
À la fin des années 1940, un bactériologiste et virologue londonien du nom de Leslie Collier a commencé à travailler sur une version lyophilisée du vaccin antivariolique. « La lymphe glycérinée produite dans ce pays se détériore rapidement à des températures supérieures à 0 °C » a-t-il indiqué dans un article consacré à ses recherches en 1955. Un vaccin plus stable s’avérerait « inestimable » pour être expédié vers des régions dépourvues de réfrigération, écrivait-il – et il l’avait découvert. Le virus du mouton déshydraté dans de la peptone à 5 % « est à nouveau parvenu à un quota complet de primovaccinations réussies chez les enfants, avec une conservation pendant 12 mois à 22 °C ou pendant 4 mois à 37 °C », a rapporté Leslie Collier.
Bientôt, le personnel de santé dans les pays endémiques pourrait transporter le vaccin dans un sac pendant un mois, tout en étant en mesure d’administrer une injection protectrice. « Un puissant vaccin déshydraté était un outil essentiel pour faire de l’éradication de la variole une réalité » écrivait Donald A. Henderson, responsable des efforts d’éradication à l’OMS, en repensant à la découverte capitale de Leslie Collier depuis le seuil du triomphe en 1976.
Élimination de la variole
Au cours des dix premières années de la mission consacrée à l’éradication, les progrès se sont fait attendre. « Dans les pays où la variole était endémique en 1959, relativement peu d’entre eux avaient atteint le statut de pays exempt de variole à la fin de l’année 1965 », a indiqué l’OMS dans sa publication de 1968 La deuxième décennie de l’Organisation mondiale de la Santé. En outre, le Pérou, autrefois exempt de variole, enregistrait à nouveau des cas de transmission. « Les échecs des différents programmes étaient largement imputables au manque de moyens de transport et de personnel, et à l’insuffisance des stocks de vaccins lyophilisés », ont diagnostiqué les auteurs.

L’Assemblée mondiale de la santé de 1966 a donné le coup d’envoi d’un nouvel élan en mettant l’accent sur la vaccination de masse. Outre les quantités produites par les pays endémiques, 200 millions de doses de vaccins lyophilisés devraient être envoyées depuis l’étranger, selon les spécialistes. L’Union soviétique s’est mobilisée, en fournissant 80 % des doses qui ont contribué à l’effort par l’intermédiaire de l’OMS.
Les progrès ont rapidement été fulgurants. En 1970, 18 pays ont signalé des cas endémiques. En 1973, seuls le Bangladesh, l’Éthiopie, l’Inde, le Népal et le Pakistan étaient endémiques. En octobre 1977, un jeune cuisinier hospitalier en Somalie, Ali Maow Maalin, est devenu le dernier patient atteint de la variole au monde.
Six vaccins supplémentaires pour six maladies supplémentaires – retour à la case départ ?
Il existait d’autres maladies évitables par la vaccination dont il fallait se préoccuper. Lors de l’Assemblée mondiale de la santé de 1974, un consensus multilatéral s’était dégagé sur le fait qu’il convenait de s’en préoccuper collectivement.
Stimulé en grande partie par le succès du programme de lutte contre la variole – « un exemple remarquable de ce qui peut être accompli » écrivait le directeur général de l’OMS en 1971 – le programme élargi de vaccination (PEV) invitait les États membres à « élaborer ou maintenir » des programmes de vaccination et de surveillance contre « la diphtérie, la coqueluche, le tétanos, la rougeole, la poliomyélite, la tuberculose, la variole et d’autres maladies, le cas échéant ». 3
La campagne contre la variole a fourni un modèle rudimentaire : des systèmes de distribution de vaccins par étapes qui ont mobilisé l’infrastructure sanitaire existante, mais qui ont été séparés des systèmes de distribution des médicaments habituels. Mais comme l’a souligné la délégation de l’URSS lors de la 29e Assemblée mondiale de la santé, « une série de problèmes non résolus » subsistait. Ce projet, tout d’abord, s’inscrit dans une temporalité différente : continue, indéfinie.
Ensuite, le besoin de vaccins efficaces sous les climats tropicaux n’était toujours pas satisfait. Les vaccins sont des produits biologiques – chacun est différent. Tous les vaccins de la première cohorte du PEV, sauf un, étaient sensibles à la chaleur, et certains étaient sensibles au gel. Contrairement au vaccin antivariolique stabilisé de Leslie Collier, ils ne supporteraient pas un mois dans le sac d’un membre du personnel de santé hors réseau.
Serait-il possible de les stocker, de les transporter et de les administrer en toute sécurité aux enfants dans des pays chauds où les réseaux électriques sont limités ? Il a été décidé que le Ghana jouerait le rôle de pays pilote pour le découvrir. Au milieu de l’année 1976, le pays d’Afrique de l’Ouest s’est lancé dans l’aventure.
Faire le point sur le défi de la chaîne du froid
Il est vite apparu que les réfrigérateurs de cuisine standard n’allaient pas suffire.
« Les températures ambiantes sur le terrain sont souvent supérieures à 40 °C et l’alimentation électrique pour la réfrigération est souvent peu fiable ou inexistante », écrivait John S. Lloyd, consultant pour l’OMS, dans un rapport de 19774 basé sur les recherches menées pendant le projet pilote ghanéen. « Dans ces conditions, les réfrigérateurs domestiques et les boîtes à pique-nique fabriqués en Europe sont totalement inadaptés. De construction fragile et généralement endommagés à la livraison, ces réfrigérateurs sont invariablement insuffisamment isolés et sous-alimentés ; ils n’indiquent pas non plus la température et ne peuvent pas être adaptés aux installations d’alimentation de secours. »
Revirement historique : envisager le réfrigérateur
En raison de sa finalité, et souvent de sa forme, le réfrigérateur ressemble à son prédécesseur, la glacière, mais tandis que l’un se contente de stocker des « dépôts de froid » d’origine naturelle, l’autre crée du froid en brûlant de l’énergie.
Ce sont les aliments, et non les produits biologiques biomédicaux, que la population a initialement cherché à conserver à des températures fraîches. C’est assez simple en hiver, mais en été, ou sous des climats plus chauds, il a fallu innover. Dès le troisième millénaire avant notre ère, un roi du nom de Shulgi dans la ville d’Ur (région de Sumer), s’est vanté de posséder une « glacière ». L’écrivain scientifique Tom Jackson suggère qu’il s’agissait probablement d’un trou creusé dans le sol, isolé avec du bois, dans lequel était stockée la glace ramassée dans les montagnes.
Dans les pays plus riches, les États-Unis par exemple, les glacières domestiques – des armoires souvent fabriquées en bois, recouvertes d’étain ou de zinc et refroidies par un bloc de glace – étaient courantes à la fin des années 1800. À cette époque, la glace naturelle stockée était également utilisée pour conserver le produit de la pêche sur les navires britanniques. La « récolte de glace » était une industrie florissante.
Mais créer des températures froides, plutôt que de les préserver, représentait un défi technique tout à fait différent.
La réfrigération artificielle via le refroidissement par évaporation a été démontrée pour la première fois par William Cullen à l’université de Glasgow en 1748. Il a obtenu ce résultat en faisant bouillir de l’éther éthylique dans un vide partiel. Il n’a toutefois pas transformé sa découverte en instrument. Au cours des décennies suivantes, d’autres scientifiques ont testé d’autres modèles, en utilisant d’autres réfrigérants. La première machine frigorifique commercialisée était basée sur l’air comprimé et a été vendue par Alexander Twinning en 1856.
Le premier réfrigérateur domestique est apparu sur le marché américain en 1913. Il s’agissait d’une unité de réfrigération électrifiée superposée sur une glacière. Les premiers réfrigérateurs domestiques étaient coûteux, un modèle de 1922 coûtant beaucoup plus cher qu’une Ford T.
En 2007, près de 1,3 milliard de réfrigérateurs domestiques et 350 millions de m3 d’unités de stockage frigorifiques étaient utilisés dans le monde. En 2006, on estimait à 1 300 le nombre total de cargos frigorifiques spécialisés, à 80 000 le nombre de wagons frigorifiques, à 650 000 le nombre de conteneurs frigorifiques et à 1,2 million le nombre de camions frigorifiques.
Une chaîne du froid fonctionnelle à l’échelle mondiale nécessitait des installations sur mesure. À Korle-Bu, Accra, un entrepôt central national de vaccins doté d’un espace flexible avec des étagères et des températures variables allant de -20 °C à +4 °C était nécessaire. Un système d’alarme devait signaler la défaillance du compresseur, et un circuit spécial à sécurité intégrée devait créer un « filet de sécurité » pour ce stock de vaccins particulièrement important et précieux. En outre, un enregistreur de température était nécessaire et il convenait de l’utiliser exclusivement pour les vaccins, écrivait le consultant de l’OMS.
Dans leur état d’origine, les entrepôts régionaux présentaient des lacunes, avait constaté John S. Lloyd. Les congélateurs à compression utilisés dans ces entrepôts ne disposaient pas d’une source d’énergie alternative pouvant être activée en cas de coupure de courant. En outre, ils étaient si mal isolés qu’ils dégelaient en moins de cinq heures en cas de coupure d’électricité. John S. Lloyd a suggéré d’avoir recours à des « armoires » mieux isolées avec un « stock tampon permanent de glace » et une source d’énergie pouvant passer rapidement de l’électricité au gaz ou au kérosène.
Au niveau du district, des glacières de 75 litres remplies de glace provenant de l’entrepôt régional permettraient de maintenir une température stable pendant sept jours, dès lors qu’elles n’étaient pas ouvertes. Produire du froid, plutôt que de le conserver, s’avérait plus difficile. « Dans l’entrepôt du district, il n’y a généralement pas d’électricité ou celle-ci n’est fournie que par intermittence », écrivait John S. Lloyd. Les réfrigérateurs alimentés au kérosène devraient convenir, même si les brûleurs au kérosène sont « connus pour leurs mauvaises performances au Ghana, comme dans de nombreux autres pays africains ».
L’analyse de John S. Lloyd s’est répercutée sur la chaîne de ramification jusqu’à ses tout derniers maillons. Les glacières transportées par véhicule permettraient d’effectuer un grand nombre de vaccinations quotidiennes, mais dans le nord du pays, les vaccinateurs se déplaceraient à pied à partir d’un camp temporaire et pourraient uniquement vacciner une cinquantaine de bébés par jour.
Mais le personnel de santé en charge de l’inoculation saurait-il si le vaccin est encore efficace à ce moment-là ? La date d’expiration d’un vaccin dépend non seulement de la durée, mais aussi de la température. John S. Lloyd craignait que l’enregistrement manuel soit trop facile à oublier ou ne génère trop d’erreurs. « Le développement récent le plus prometteur dans ce domaine est un indicateur de durée/température à base d’enzymes contenu sur une languette de papier jointe à l’emballage du vaccin », écrivait-il.
Innovation en matière de froid
Si l’évaluation de John S. Lloyd au Ghana a révélé à quel point le défi allait être difficile à relever, il n’a pas fallu attendre très longtemps pour que les obstacles soient levés.
PATH, une organisation à but non lucratif, a entrepris de créer des enregistreurs de température automatisés, un point que John S. Lloyd avait identifié comme étant une lacune préoccupante. Un processus itératif d’invention a permis de produire, au début des années 1990, des pastilles de contrôle des vaccins (PCV) commercialement disponibles : il s’agit d’un autocollant portant une cible lilas qui change de couleur en cas de défaillance de la température. En 1999, tous les flacons de vaccins achetés par l’intermédiaire des Nations Unies devaient en être équipés ; en 2002, le Conseil d’administration de Gavi les a exigées sur tous les vaccins achetés par l’Alliance du Vaccin à compter de 2004.
Non seulement les pastilles ont donné aux systèmes de santé la garantie qu’aucun vaccin endommagé par la chaleur n’était administré aux enfants, mais elles ont également contribué à réduire considérablement les pertes. Grâce à la garantie offerte par les PCV, les flacons multidoses ont pu être utilisés pendant plus d’une journée, au lieu d’être jetés, par excès de prudence, à la fin d’une séance de vaccination.
D’autres outils de suivi de la température ont permis aux systèmes de santé d’avoir une vision plus précise des points faibles de leur chaîne du froid. La société suisse Berlinger & Co. AG, par exemple, produit un enregistreur de température sur 30 jours (30DTR), un appareil intelligent qui peut signaler, en détail, des fluctuations de température dans les grands entrepôts de vaccins.
La glacière pour vaccins a été une autre invention cruciale – qui allait rapidement devenir le symbole de la livraison des vaccins « sur le dernier kilomètre ». Une version en bois de première génération a été créée en 1974 par le Laboratoire national de bactériologie de Suède. La société Electrolux s’en est inspirée pour créer une glacière passive transportable qui pouvait rester fraîche pendant cinq jours par 43 °C.
Mais créer du froid lorsque les températures étaient élevées et avec peu d’énergie restait complexe. Les réfrigérateurs à absorption fonctionnant au kérosène, au gaz ou à l’électricité étaient privilégiés dans les pays en développement, mais ils ne permettaient pas de maintenir les plages de température requises et ne pouvaient pas congeler les blocs de glace dans les volumes nécessaires pour stocker les glacières passives destinées au transport des vaccins. En outre, les sources de combustible étaient souvent frelatées, ce qui entraînait des pannes fréquentes.
Des réfrigérateurs de meilleure qualité ont été conçus spécifiquement pour les climats plus chauds. L’appel de John S. Lloyd en faveur d’une unité frigorifique dotée d’un stock tampon de glace permanent a été satisfait par le réfrigérateur à gaine réfrigérante (ILR, pour Ice-Lined Refrigerator) – aujourd’hui, le choix standard pour les filières de la chaîne du froid dont l’alimentation électrique n’est pas fiable. Et, à partir de 1979, Electrolux a créé une gamme de petites unités spécialement destinées aux centres de santé, sur la base de la glacière portable. Ces appareils sont utilisés depuis des décennies.
Crédit : Gavi/2023/Prakhar Deep Jain
La chaîne du froid continue à évoluer. Même si les réseaux électriques de nombreux pays se sont développés et améliorés, les programmes élargis de vaccination (PEV) nationaux continuent à moderniser leur technologie en matière de refroidissement afin d’utiliser des sources d’énergie plus propres et plus fiables – 50 % des réfrigérateurs pour vaccins installés par l’UNICEF dans les systèmes de santé du monde entier depuis 2017 sont alimentés par l’énergie solaire.

Rome a construit des routes, les PEV ont construit la chaîne du froid
Cinquante ans se sont écoulés depuis que les États membres de l’OMS sont convenus que la poursuite d’une vaccination équitable méritait l’énergie et l’ingéniosité considérables qu’elle exigerait. Les chiffres confirment ce pari. La vaccination a sauvé 154 millions de vies depuis 1974. Aujourd’hui, un enfant âgé de moins de dix ans a 40 % de chances supplémentaires de survivre jusqu’à son prochain anniversaire que le même enfant il y a un demi-siècle.
Cette réussite est le fruit des efforts de millions de personnes : parents, virologues et bactériologistes, ministres, épidémiologistes, spécialistes de l’énergie solaire, personnel de santé ouvrant la porte d’un ILR, vaccinateurs portant leur glacière pour vaccins bleue sur l’épaule, techniciens de la réfrigération et spécialistes des panneaux solaires. L’échafaudage qu'ils ont gravi – et la trace de leurs efforts collectifs – est constitué de réfrigérateurs et de glacières.
Zoom sur la chaîne du froid au Soudan du Sud
Il s’agit du pays le moins électrifié au monde, avec des températures lors de la saison sèche qui atteignent périodiquement les 40 degrés Celsius. Il n'existe sans doute pas beaucoup d’endroits où la chaîne du froid est plus difficile à maintenir sans interruption. Et pourtant, le Soudan du Sud a réussi à vacciner de plus en plus d’enfants chaque année depuis 2016, administrant au moins une dose à 76 % des enfants en 2022. Nous avons demandé à notre reporter à Juba, Winnie Cirino, d’examiner de près la manière dont le pays maintient ses vaccins au frais.
« Les vaccins sont transportés depuis l’aéroport vers l’entrepôt national des vaccins », a expliqué Victor Sule, responsable de la vaccination à l’UNICEF, à Winnie Cirino. « Des enregistrements sont effectués après inspection et des rapports relatifs à l’arrivée des vaccins sont rédigés, puis les vaccins sont stockés au sein de l’entrepôt national des vaccins où il y a une chambre froide fonctionnelle [et] un entrepôt frigorifique fonctionnel, pour le stockage des vaccins. »
Ensuite, chaque trimestre, les vaccins sont distribués dans les États du Soudan du Sud, en fonction des rapports de fin de trimestre concernant leurs stocks. Pour les 37 comtés qui ne peuvent être atteints par la distribution au niveau de l’État en raison du mauvais état des routes ou pour des questions d’insécurité, les vaccins sont largués par avion au niveau national.
Dans de nombreux comtés, les réfrigérateurs fonctionnant à l’énergie solaire ont fait une énorme différence. Des comtés à l’image de Mingkaman, qui dépendent encore de réfrigérateurs alimentés par des générateurs, sont comme un « retour en arrière », à l’époque où les technologies de la chaîne du froid fonctionnant au kérosène ou au gaz représentaient la seule option dans de nombreux endroits. Daniel Achop, responsable du PEV au sein de la chaîne du froid du comté de Mingkaman, a expliqué à Winnie Cirino : « Nous utilisons un générateur pour les services du PEV. S’il s’éteint, comme c’est le cas maintenant, nous ne pouvons rien faire. Le partenaire qui nous fournit le carburant nous dit qu’il n’en a pas assez pour l’instant », ajoute Daniel Achop. Les vaccins ont été transférés dans le centre de santé primaire, indique-t-il, mais l’espace dans la chambre froide de l’établissement est restreint et le risque de perte de doses est clairement une inquiétude.
Références
- 1. Edward Jenner lui-même (pionnier du concept des vaccins et créateur du vaccin contre la variole) a suggéré d’expédier de la lymphe de variole déshydratée entre deux plaques de verre, puis de la réhydrater avec de l’eau une fois arrivée à destination. Malheureusement, cette méthode a souvent échoué. D’autres vaccinateurs ont transporté de la lymphe à l’état liquide, dans la pointe d’une lancette, mais sous cette forme, elle ne se conservait au maximum que deux ou trois jours. Du vivant d’Edward Jenner, il était déjà évident qu’il serait encore plus difficile d’acheminer la lymphe vers les climats chauds que de la transporter au sein de l’Europe tempérée – bien qu’en 1802, au moins une tentative d’expédition de lymphe utilisable vers l’Inde ait été couronnée de succès. Andrea Rusnock, historienne spécialiste des sciences et de la médecine, revient sur ces premiers efforts fascinants pour établir un réseau de transport des vaccins.
- L’historienne Kristin Brig-Ortiz, interviewée par VaccinesWork ici, a travaillé sur cette question.
- Le WHA30.53, adopté en 1977, a fixé des objectifs pour le PEV : vacciner tous les enfants du monde d’ici 1990, en particulier contre la diphtérie, la coqueluche, le tétanos, la rougeole, la poliomyélite et la tuberculose, et réduire la morbidité et la mortalité dues à d’autres maladies sélectionnées, importantes pour la santé publique, pour lesquelles des vaccins sûrs et efficaces existent actuellement ou deviennent disponibles. »
- John S. Lloyd (1977) « Improving the cold chain for vaccines » (Améliorer la chaîne du froid pour les vaccins), Chronique de l’OMS 31 : 13-18.
Davantage de Gavi Staff
Recommandé pour vous