Virus Marburg en Guinée équatoriale : pourquoi l’OMS a convoqué une réunion d’urgence
Le 13 février, les autorités de Guinée équatoriale ont confirmé une flambée du virus Marburg dans l’est du pays. Moins de 24 h plus tard, l’Organisation mondiale de la Santé (OMS) convoquait une réunion d’urgence sur la question.
- 23 février 2023
- 8 min de lecture
- par The Conversation
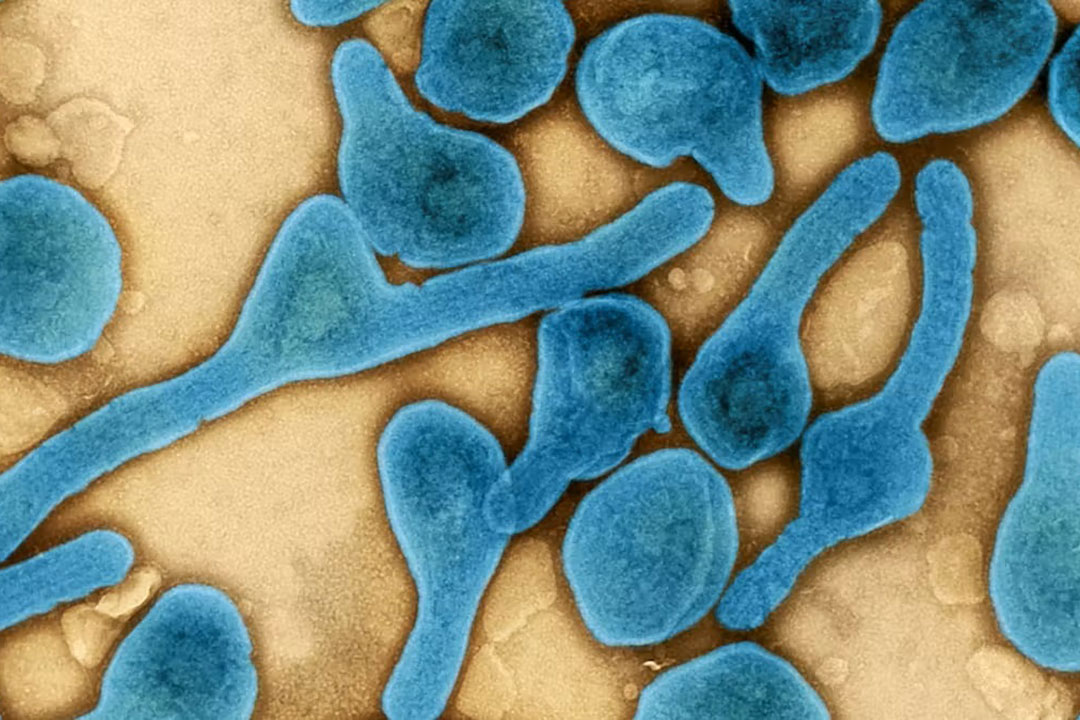
Appartenant à la même famille que le virus Ebola (Filoviridae), le virus Marburg est responsable de graves fièvres hémorragiques chez l’être humain. L’OMS indique que sa létalité est de l’ordre de 50 % (elle varie de 24 % à 88 % selon les études). Elle dépend notamment de la quantité de particules virales transmises au moment de l’infection et de la qualité de prise en charge des patients.
Que faut-il savoir sur la situation en Guinée équatoriale ? Pourquoi l’OMS a-t-elle convoqué une réunion en urgence ? La situation est-elle préoccupante ?
Quand l’alerte a-t-elle été donnée ?
L’alerte a été donnée dès le 7 février, dans le district de la province de Kie Ntem, dans l’est de la Guinée équatoriale. Cette partie du pays est frontalière avec le Cameroun au nord, et le Gabon à l’est. Il s’agit d’une zone plutôt rurale et forestière, avec de petites villes et villages, sans grand centre urbain.
Plusieurs malades ont présenté les mêmes symptômes, et des décès groupés sont survenus, ce qui a déclenché l’alerte. Dans un tel cas de figure, des prélèvements sont effectués et envoyés dans des centres de référence, en l’occurrence l’Institut Pasteur de Dakar, le centre de référence pour les fièvres hémorragiques dans cette région. Les analyses ont confirmé que le virus impliqué était le virus Marburg.
C’est la première fois qu’une flambée est confirmée en Guinée équatoriale : il s’agit donc d’une véritable émergence, dans un pays a priori sans historique de virus de fièvres hémorragiques. Les derniers cas de Marburg ont été enregistrés en 2021 en Guinée-Conakry et au Ghana, deux pays éloignés de la Guinée équatoriale.
Pour l’instant, 9 décès sont survenus, et 16 cas suspects ont été enregistrés (deux cas suspects concernent des personnes au Cameroun, à la frontière avec la Guinée équatoriale).
Pourquoi une telle réunion d’urgence ?
Avant tout, il est important de préciser que la réunion du 14 février n’a pas été convoquée pour alerter sur une éventuelle urgence de santé publique de portée internationale.
L’objet de ce meeting, auquel ont participé les spécialistes du virus Marburg de nombreux pays, était, entre autres choses, de faire le point sur les vaccins contre cet agent infectieux et les traitements en cours d’élaboration : état des recherches et développements, des essais cliniques, etc.
À l’heure actuelle, en effet, il n’existe aucun traitement spécifique pour la maladie du virus de Marburg (ni préventif ni curatif). Mais diverses pistes sont explorées, que ce soit par la recherche académique ou le secteur pharmaceutique. Des personnes du monde entier possédant des données sur des vaccins ou des traitements à l’étude ont donc été invitées : chercheurs, représentants de firmes pharmaceutiques, etc.
L’idée était de déterminer au plus vite les conditions les plus pertinentes pour mettre en place d’un essai clinique de phase 3, dans le cadre de l’épidémie en cours, afin de récolter des données cliniques de terrain concernant l’efficacité des candidats vaccins ou médicaments jugés pertinents.
L’obtention de telles données de terrain est en effet le seul moyen de répondre à la question « est-ce que le vaccin (ou le médicament) est efficace pour prévenir ou traiter la maladie ? ».
Quelles sont les prochaines étapes ?
Afin de mettre en place un tel essai, plusieurs prérequis sont nécessaires.
Il faut sélectionner les candidats vaccins et médicaments les plus pertinents, discuter avec les experts qui les mettent au point pour connaître leur niveau de développement (préclinique, phase 1, phase 2…), déterminer quelles quantités de doses sont disponibles (ce qui peut nécessiter de faire des tests de stabilité pour vérifier la fiabilité des doses qui ont été stockées depuis longtemps), mettre en place les chaînes logistiques destinées à acheminer les doses sur le terrain, etc.
Les discussions concernent aussi la validation du protocole d’évaluation clinique : quels critères d’efficacité retenir (innocuité, effet sur le nombre de cas, protection contre l’infection, contre les formes fatales, etc.), quel type d’essais mettre en place, combien de patients devront être inclus pour que l’analyse statistique soit robuste, etc.
Une fois ces questions tranchées, l’investigateur principal et le promoteur de l’étude doivent rédiger le protocole de l’essai. Il s’agit de détailler les produits utilisés, la méthodologie, la notice d’information qui sera donnée et lue aux patients, ainsi que le questionnaire de consentement (rédigés dans la ou les langues ad hoc).
Le dossier est ensuite soumis aux autorités de Guinée équatoriale, ainsi qu’au comité national d’éthique, qui doivent donner leur accord. Enfin, des contrats devront être établis avec les firmes qui développent le (ou les) candidat(s) vaccin(s) retenu(s). Une fois que tout est validé et signé, la recherche peut débuter.
Mais ce n’est pas tout : pour que ce type de projet soit un succès, il faut aussi s’assurer de l’engagement communautaire. Cela signifie engager des démarches auprès de la communauté où se déroule l’épidémie, afin d’expliquer pourquoi, en parallèle de la prise en charge des malades, il est important d’effectuer des travaux de recherche. Cette partie repose sur l’expertise de socioanthropologues.
Pour aller plus loin
Ces nombreuses étapes prennent du temps, c’est la raison pour laquelle cette réunion a été convoquée très rapidement, moins de 24 h après l’alerte.
L’OMS et les experts souhaitaient éviter de reproduire ce qui s’est passé en Ouganda durant la flambée d’Ebola qui a touché ce pays entre septembre 2022 et janvier 2023. Il n’avait en effet pas été possible d’évaluer l’efficacité du candidat vaccin retenu à cette occasion, car le temps que l’essai clinique se mette en place, l’épidémie était terminée. L’idée cette fois est de réagir encore plus rapidement.
Rappelons qu’en 2015, en Guinée, il avait été possible de mettre en place un essai clinique de phase 3 durant une épidémie d’Ebola, ce qui avait permis de tester l’efficacité clinique du vaccin sur le terrain. Les résultats obtenus, convaincants, ont permis par la suite d’utiliser ce vaccin lors d’épidémies ultérieures.
Quels vaccins et médicaments pourraient être retenus ?
Actuellement cinq candidats vaccins sont en développement. Deux ont déjà fait l’objet d’essais cliniques de phase I pour lesquels les données sont disponibles : celui développé par la firme Sabin et celui de la firme Janssen.
Le vaccin de Janssen nécessitant l’administration de deux doses, il est possible que celui de Sabin soit le mieux positionné pour intégrer un essai clinique dans le contexte de la flambée actuelle. Mais nous avons besoin de plusieurs options et stratégies vaccinales.
En ce qui concerne les thérapies potentielles, deux pistes principales se détachent : les anticorps monoclonaux, déjà utilisés pour lutter contre Ebola, et le Remdesivir, une molécule qui perturbe la réplication de l’ARN, le matériel génétique de certains virus de fièvres hémorragiques (Marburg, Ebola, Lassa…).
De ces deux approches, cependant, celle des anticorps monoclonaux semble la plus prometteuse en l’état actuel des connaissances, car contre Ebola les anticorps se sont avérés plus efficaces que le Remdesivir.
Comment seront mis en place les essais ?
En ce qui concerne les thérapies potentielles, le standard est de faire un essai dit « randomisé ». Des patients sont tirés au sort, puis un groupe reçoit la prise en charge standard (le « standard of care »), tandis que l’autre groupe reçoit la même prise en charge avec, en plus, une des molécules à évaluer (anticorps monoclonal, Remdesivir, ou autres molécules, selon ce qui aura été décidé).
Durant l’essai, un comité d’évaluation indépendant, constitué de scientifiques qui ne sont pas parties prenantes, est invité à analyser régulièrement les données. Si une des molécules testées s’avère efficace (c’est-à-dire largement supérieure au traitement donné à l’autre groupe), l’essai peut être interrompu : ladite molécule est alors délivrée à tous les malades. À l’inverse, si les données intermédiaires ne sont pas satisfaisantes, l’essai peut être arrêté pour « futilité » (tout le monde est alors à nouveau traité selon la prise en charge standard).
Une des approches d’évaluation du vaccin est la méthode dite en « anneaux » : on vaccine les contacts des malades, puis les contacts des contacts, afin d’estimer l’efficacité du candidat vaccin en matière de prévention de la maladie (un groupe à un temps immédiat, un autre groupe à un temps légèrement retardé).
En Guinée équatoriale, une grande inconnue concerne le nombre de malades à venir et la durée de l’épidémie. En effet, pour pouvoir conduire des analyses statistiques robustes et être en mesure de conclure à un niveau d’efficacité, il est nécessaire de pouvoir inclure dans l’essai un nombre de sujets suffisant. Il n’est pas certain que ce sera le cas.
Toutefois, même s’il ne s’avérait pas possible d’obtenir ces résultats lors de cette épidémie, tous ces efforts n’auront pas été vains : lors de la prochaine flambée,le protocole sera prêt et disponible pour récolter des données qui serviront à mieux nous armer contre les suivantes…![]()
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.
Auteur
Eric D'Ortenzio, Médecin, Epidémiologiste, Responsable du département Statégie & Partenariats, ANRS I Maladies infectieuses émergentes, Inserm

Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.
Déclaration d’intérêts
The authors do not work for, consult, own shares in or receive funding from any company or organisation that would benefit from this article, and have disclosed no relevant affiliations beyond their academic appointment.
Partenaires

L'Inserm apporte un financement en tant que membre adhérent de The Conversation FR.
Davantage de The Conversation
Recommandé pour vous









